- 技术服务
- 产品服务
- 行业新闻
- 公司公告:本公司从2022年6月1日开始实施新药全酶谱筛选 热烈祝贺济南华维医药正式迁入中国济南药谷!!! 诺华Jakavi® (ruxolitinib)首获欧盟批准用于骨髓纤维化
- 更多新闻>>
- 公司概况
- 更多信息>>
- 联系我们
- 电 话: 15821697315 微信号: 15821697315 QQ: 1621015150
- 0531-58990387
- 传 真: 021-64828900
- 1621015150@qq.com
- 位置 > 首页 > 4. 细胞水平新药筛选详细说明 > 4.2.6 细胞凋亡实验
- 服务描述
4.2.6 细胞凋亡实验
【生物背景】
细胞凋亡是一个主动的信号依赖过程,可由许多因素诱导,如放射线照射、缺血缺氧、病毒感染、药物及毒素等。这些因素大多可通过激活死亡受体而触发细胞凋亡机制。死亡受体存在于细胞表面。属于肿瘤坏死因子受体超家族,它们与相应的配体或抗体结合而活化后,其胞浆区即可与一些信号转导蛋白结合,其中重要的是含有死亡结构域的胞浆蛋白。它们通过死亡结构域一方面与死亡受体相连,另一方面与下游的capase蛋白酶结合,使细胞膜表面的死亡信号传递到细胞内。capase蛋白酶家族作为细胞凋亡的执行者,它们活化后进一步剪切底物,如多聚(ADP-核糖)聚合酶(PARP)该酶与DNA修复及基因完整性监护有关,PARP被剪切后,失去正常的功能,使受其抑制的核酸内切酶活性增高,裂解核小体间的DNA,最终引起细胞凋亡。这个过程可概括为:死亡受体含有死亡结构域的胞浆蛋白—capase蛋白酶家族—底物PARP—染色体断裂—细胞凋亡。不同种类的细胞在接受不同的细胞外刺激后引起凋亡的形态学改变是高度保守的,但是它们并不是遵循同一种固定的或有规律的模式进行,而是通过各自的信号转导途径来传递胞膜上的死亡。
磷脂酰丝氨酸外翻分析(Annexin V法)是分析凋亡细胞的常用方法。磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。
TUNEL法 也是检测细胞凋亡的常见方法。 在细胞凋亡过程中, 染色体DNA双链断裂或单链断裂而产生大量的粘性3'-OH末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到DNA的3'-末端,从而可进行凋亡细胞的检测,这类方法称为脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal -deoxynucleotidyl transferase mediated nick end labeling, TUNEL)。由于正常的或正在增殖的细胞几乎没有DNA的断裂,因而没有3'-OH形成,很少能够被染色。TUNEL实际上是分子生物学与形态学相结合的研究方法,对完整的单个凋亡细胞核或凋亡小体进行原位染色,能准确地反应细胞凋亡典型的生物化学和形态特征,可用于石蜡包埋组织切片、冰冻组织切片、培养的细胞和从组织中分离的细胞的细胞形态测定,并可检测出极少量的凋亡细胞,因而在细胞凋亡的研究中被广泛采用。
Caspase-3活性的检测 ,Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中caspase-3为关键的执行分子,它在凋亡信号传导的许多途径中发挥功能。Caspase-3正常以酶原(32KD)的形式存在于胞浆中,在凋亡的早期阶段,它被激活,活化的Caspase-3由两个大亚基(17KD)和两个小亚基(12KD)组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。但在细胞凋亡的晚期和死亡细胞,caspase-3的活性明显下降。 Western blot 分析Procaspase-3的活化,以及活化的Caspase-3及对底物多聚(ADP-核糖)聚合酶[poly(ADP-ribose)polymerase,PARP]等的裂解。
【筛选项目】
Cell apoptosis Assays
1.Annexin-v-FITC / PI双染法;
2.TUNEL法;
3.Caspase-3激活;
【筛选价格】
周期:4-6周
送样量2~3mg
每个化合物测试每个细胞株的细胞凋亡影响:360元/孔。(起测量至少8个孔)
【结果示例】
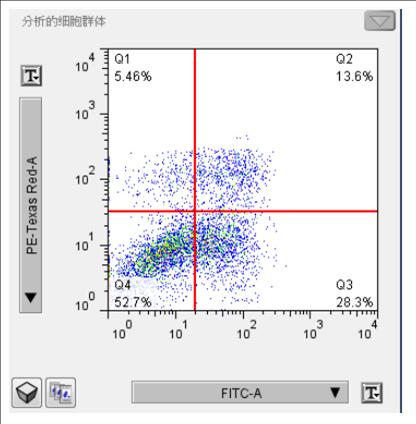
Q1:(AnnexinV-FITC)-/PI+,此区域的细胞为坏死细胞。也可能有少数的晚期凋亡细胞在其中,甚至机械损伤的细胞也包含其中。
Q2: (AnnexinV+FITC)+/PI+,此区域的细胞为晚期凋亡细胞。
Q3:(AnnexinV-FITC)+/PI-,此区域的细胞为早期凋亡细胞。
Q4:(AnnexinV-FITC)-/PI-,此区域的细胞为活细胞。
- 现在咨询>>
- 相关服务概述>>
- 地址:山东省济南市高新区港兴三路济南药谷1号楼A座2508
- 电话:15821697315 微信号: 15821697315 QQ: 1621015150 / 0531-58990387 传真:021-64828900
- Powered by TANG 3.6 Copyright @ 2012 - 2015 唐尧生物
